■■ klinik & vetenskap översikt
Mitokondrie­
byte – potentiell
terapimetod
med etiska
implikationer
Svår sjukdom kan möjligen förhindras,
men kunskapsluckor finns
KARIN WILBE RAMSAY, med dr,
utredningssekreterare, Statens
medicinsk-etiska råd, Stockholm
karin.wilbe-ramsay@
regeringskansliet.se
CHARLES HANSON, docent i re-
produktionsgenetik, enheten
för reproduktionsmedicin, Sahlgrenska universitetssjukhuset,
Göteborg
KJELL ASPLUND, professor, ordförande, Statens medicinsk-­
etiska råd, Stockholm
Över hundra sjukdomar och syndrom finns under samlingsnamnet mitokondriella sjukdomar. Av dessa orsakas vissa av
mutationer i cellkärnans DNA och andra av mutationer i mitokondriernas eget DNA (mtDNA). I båda fallen orsakar mutationerna defekter i energiomvandlingen (ATP-syntesen) i
andningskedjan. De sjukdomar som orsakas av mutationer i
mtDNA (mtDNA-sjukdom) nedärvs maternellt, eftersom endast äggets mitokondrier går över bestående till det blivande
barnet vid befruktningen.
Vid mtDNA-sjukdom finns ofta en blandning av normalt
och muterat mtDNA i olika proportioner i cellerna (s k heteroplasmi). Det förekommer även att allt mtDNA är muterat
(s k homoplasmi). Nivån av heteroplasmi återspeglas till viss
del i cellernas och vävnadernas funktion. Samma mutation
kan yttra sig på flera olika sätt, vilket bl a beror på att nivån
av heteroplasmi varierar hos olika individer. Symtomen kan
dock vara olika även hos två individer med samma nivå av heteroplasmi, vilket medför att sjukdomens svårighetsgrad är
svår att förutse genom genetisk diagnostik (t ex fosterdiagnostik).
Sjukdomsbilden vid mitokondriella sjukdomar är heterogen, men vissa vävnader och organ är särskilt drabbade eftersom de är extra känsliga för störningar i energiomsättningen,
t ex centrala nervsystemet, muskler och njurar. Sjukdomen
kan ibland visa sig redan vid födseln eller resultera i missfall
under graviditeten. Hos en del visar sig symtomen senare i livet, ibland först vid vuxen ålder. Exempel på symtom vid mtDNA-sjukdom är påverkan på hörsel och syn, muskelförtvining, svaghet, hjärt-, lever- och njursjukdom, utvecklingsstörning, autism, epilepsi, diabetes och andra hormonella
störningar.
Sjukdomarna kan vara lindriga men är ofta allvarliga, och
många av de drabbade avlider i tidig ålder. I dag saknas effektiva metoder att behandla sjukdomarna.
En kvinna som har en viss nivå av heteroplasmi kan få ett
Citera som: Läkartidningen. 2014;111:CTIH
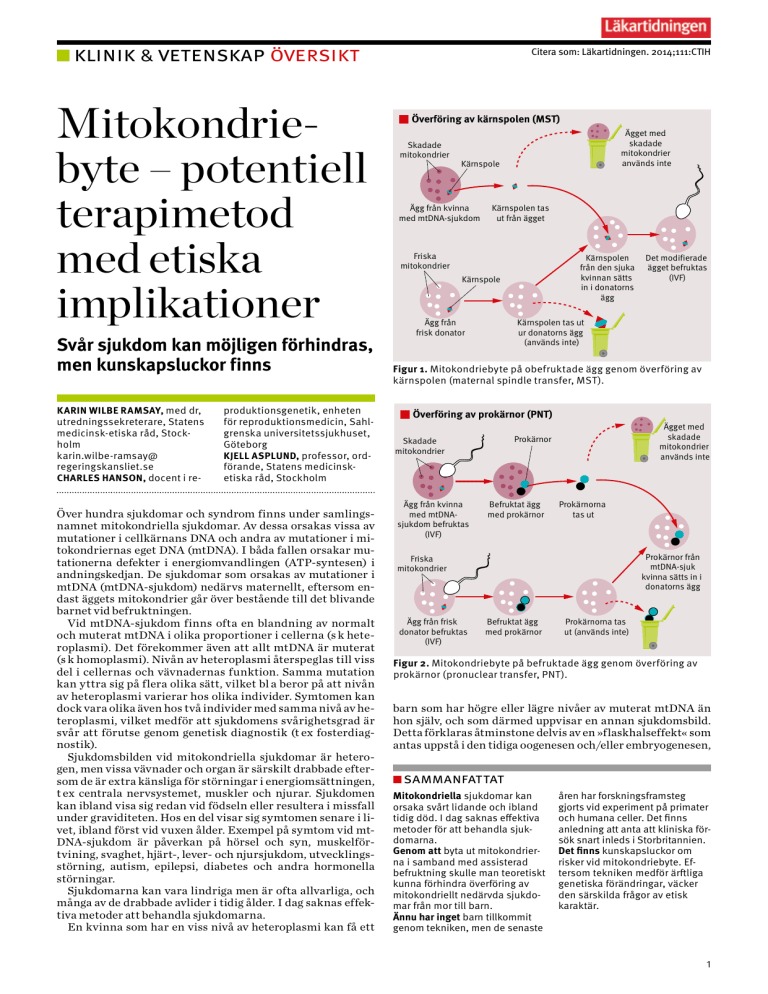
Överföring av kärnspolen (MST)
Skadade
mitokondrier
Ägget med
skadade
mitokondrier
används inte
Kärnspole
Ägg från kvinna
med mtDNA-sjukdom
Kärnspolen tas
ut från ägget
Friska
mitokondrier
Kärnspolen
från den sjuka
kvinnan sätts
in i donatorns
ägg
Kärnspole
Det modifierade
ägget befruktas
(IVF)
Kärnspolen tas ut
ur donatorns ägg
(används inte)
Ägg från
frisk donator
Figur 1. Mitokondriebyte på obefruktade ägg genom överföring av
kärnspolen (maternal spindle transfer, MST).
Överföring av prokärnor (PNT)
Ägg från kvinna
med mtDNAsjukdom befruktas
(IVF)
Ägget med
skadade
mitokondrier
används inte
Prokärnor
Skadade
mitokondrier
Befruktat ägg
med prokärnor
Prokärnorna
tas ut
Prokärnor från
mtDNA-sjuk
kvinna sätts in i
donatorns ägg
Friska
mitokondrier
Ägg från frisk
donator befruktas
(IVF)
Befruktat ägg
med prokärnor
Prokärnorna tas
ut (används inte)
Figur 2. Mitokondriebyte på befruktade ägg genom överföring av
prokärnor (pronuclear transfer, PNT).
barn som har högre eller lägre nivåer av muterat mtDNA än
hon själv, och som därmed uppvisar en annan sjukdomsbild.
Detta förklaras åtminstone delvis av en »flaskhalseffekt« som
antas uppstå i den tidiga oogenesen och/eller embryogenesen,
■■ sammanfattat
Mitokondriella sjukdomar kan
orsaka svårt lidande och ibland
tidig död. I dag saknas effektiva
metoder för att behandla sjukdomarna.
Genom att byta ut mitokondrierna i samband med assisterad
befruktning skulle man teoretiskt
kunna förhindra överföring av
mitokondriellt nedärvda sjukdomar från mor till barn.
Ännu har inget barn tillkommit
genom tekniken, men de senaste
åren har forskningsframsteg
gjorts vid experiment på primater
och humana celler. Det finns
anledning att anta att kliniska försök snart inleds i Storbritannien.
Det finns kunskapsluckor om
risker vid mitokondriebyte. Eftersom tekniken medför ärftliga
genetiska förändringar, väcker
den särskilda frågor av etisk
karaktär.
1
■■ klinik & vetenskap översikt
där endast ett fåtal slumpvist utvalda mitokondrier går vidare
från modercellen till dottercellen [1, 2].
Den exakta prevalensen av mitokondriellt nedärvda sjukdomar är inte känd, men en uppskattning är ca 1 på 10 000 [3].
forskarteam i Kina låtit återföra fem befruktade ägg som varit
föremål för MST till en kvinnas livmoder, vilket resulterade i
en trillinggraviditet [6]. Enligt medierapporteringen resulterade graviditeten i missfall efter några månader.
Situationen i dag för de patienter som vill ha barn
Barn som föds med allvarlig mitokondriell sjukdom riskerar
svårt lidande och eventuellt tidig död. Gravida kvinnor som är
bärare av mtDNA-sjukdom kan i vissa fall genomgå genetisk
fosterdiagnostik i syfte att utröna det blivande barnets risk
för att drabbas av sjukdom. Detta är endast möjligt om kvinnan bär på kända mutationer i mtDNA:t. Diagnostiken kan
dock inte ge någon tillförlitlig sjukdomsprognos, eftersom det
inte går att säkert förutsäga utifrån testresultatet hur det muterade mtDNA:t kommer att fördela sig i det blivande barnets
kropp.
Fosterdiagnostik riskerar alltså att ställa föräldrarna inför
ett svårt val mellan att avbryta eller fullfölja graviditeten,
med en osäker riskbedömning som beslutsunderlag.
Preimplantatorisk genetisk diagnostik (PGD) har även prövats som verktyg för att minska risken för överföring av mitokondriellt nedärvd sjukdom [4, 5]. Vid PGD föreligger dock
liknande problem som vid fosterdiagnostik, eftersom nivån
av heteroplasmi i en enstaka cell från blastocysten kanske
inte motsvarar nivån i det blivande barnets kropp; dessutom
måste mutationen vara välkänd för att metoden ska vara möjlig. På grund av dessa problem erbjuds inte PGD till patienter
med mtDNA-sjukdom i Sverige i dag.
Om en kvinna som bär på mtDNA-sjukdom vill ha barn i dag
får hon och hennes partner alltså mer eller mindre chansa på
att barnet inte kommer att drabbas av svår sjukdom. Om det
genetiska bandet är av mindre betydelse för föräldrarna kan
de använda sig av adoption eller äggdonation.
Metodernas effektivitet för att byta ut mitokondrierna
Forskningsstudier har visat på ett problem hos tekniker för
mitokondriebyte, vilket innebär att mitokondrierna inte alltid byts ut till 100 procent. Ofta medföljer en liten mängd
cytoplasma innehållande de ursprungliga mitokondrierna
vid både MST och PNT. Omfattningen av denna oavsiktliga
överföring är av stor betydelse, eftersom den är relaterad till
risken för sjukdom hos den blivande individen.
Mitokondriebyte för att förhindra överföring av sjukdom
Genom s k mitokondriebyte skulle man eventuellt kunna förhindra att mtDNA-sjukdomar nedärvs från en kvinna till
hennes barn. Principen innebär att man byter ut det skadade
mtDNA:t från en drabbad kvinna till »friskt« mtDNA i samband med in vitro-fertilisering (IVF). Mitokondriebytet utförs genom modifiering av antingen obefruktade eller befruktade ägg (Figur 1 och 2).
Vid modifiering av obefruktade ägg är överföring av
kärnspolen (maternal spindle transfer, MST) den metod som
för närvarande verkar mest lovande. Vid MST överförs
kärnspolen, till vilken kromosomerna är bundna, i ett ägg
från en drabbad kvinna till ett donerat ägg som i sin tur tömts
på sin kärnspole (Figur 1). Det donerade ägget kommer att
innehålla kromosomer från den drabbade kvinnan och »friska« mitokondrier från äggdonatorn, och det kan befruktas
med spermier från den tilltänkte fadern.
Vid modifiering av befruktade ägg överförs prokärnorna i
ett befruktat ägg från ett par där kvinnan bär på mtDNA-sjukdom till ett befruktat ägg som bildats utifrån ett donerat ägg
(pronuclear transfer, PNT) (Figur 2). Med denna metod erhålls samma resultat som vid MST.
MST och PNT har i forskningsstudier utförts på djur (exempelvis möss och makaker) och på obefruktade och befruktade
ägg från människor. Forskningen på området är ännu begränsad, och inget människobarn har blivit till med hjälp av teknikerna hittills. Dock rapporterades det i medier år 2003 att ett
»Forskningen på området är ännu
begränsad, och inget människobarn
har blivit till med hjälp av teknikerna
hittills.«
2
PNT. Tekniken PNT har använts på möss sedan 1980-talet,
och flera experiment har visat att metoden fungerar för att
byta ut mtDNA i befruktade ägg [1, 7]. Storleken på överföringen av oönskat mtDNA från den ursprungliga äggcellen har varierat i dessa studier. PNT har också utförts på humana befruktade ägg, vilket resulterade i normal blastocystutveckling upp till 6–8 dagar efter överföringen [8]. Blastocysterna i
denna studie innehöll i genomsnitt <2 procent av oavsiktligt
överfört mtDNA.
MST. År 2009 utfördes MST på primater (rhesusmakaker) av
en amerikansk forskargrupp [9]. De befruktade äggen utvecklades normalt och användes till att inducera dräktighet, vilket resulterade i fyra friska avkommor. Ingen överföring av
oönskat mtDNA kunde observeras hos någon av ungarna
(dock användes en teknik som endast kunde påvisa ned till 3
procent av det totala mtDNA:t). Makakungarnas utveckling
har följts upp till 3 års ålder, och hittills har inga avvikelser
rapporterats jämfört med kontroller [10]; inget oönskat
­mtDNA har heller kunnat påvisas. I en annan studie utvärderades överföring av oönskat mtDNA i många olika organ hos
makakfoster som utvecklats efter MST [2]. I alla organ kunde
endast låga (<0,5 procent) eller icke-detekterbara nivåer av
oönskat mtDNA påvisas, förutom i de fetala oocyterna där nivåer kring ca 15 procent uppmättes i vissa av proven.
Samma forskargrupp har även utfört MST på humana äggceller som sedan befruktades, vilket resulterade i normal utveckling till blastocyster med i genomsnitt 0,5 procent oavsiktligt överfört mtDNA [10].
En annan forskargrupp har utfört en variant av MST, där
man tillämpade frysning eller nedkylning av humana äggceller för att depolymerisera kärnspolen före överföringen [11].
Efter artificiell aktivering (äggen befruktades inte i denna studie) sågs normal utveckling till blastocyster med <1 procent
oavsiktligt överfört mtDNA. Från blastocysterna genererades
stamcellslinjer, som också innehöll låga nivåer av oönskat
­mtDNA, och nivåerna sjönk till icke-detekterbara under odling. Nivåerna låg kvar under detektionsgränsen efter >1 års
odling av stamcellerna och även efter differentiering till olika
celltyper.
Risker förknippade med överföring av oönskat mtDNA
De ovan nämnda studierna tyder på att en tämligen låg grad av
överföring av oönskat mtDNA kan förväntas vid optimering
av teknikerna MST och PNT (ca 0–0,5 procent respektive ca 2
procent). Sannolikheten för att sjukdom ska inträffa vid så
låga proportioner av muterat mtDNA är troligtvis liten. Exempelvis uppskattades i en studie som avsåg att vara vägledande inför PGD sannolikheten för att inte drabbas av sjukdom till 95 procent om nivån av heteroplasmi i cellerna var
<18 procent [5].
Studierna på makaker och stamcellslinjer tyder på att det
inte sker någon betydande ackumulering av muterat mtDNA i
cellerna om det har överförts i låga nivåer [10, 11]. Däremot
■■ klinik & vetenskap översikt
»Storbritanniens regering meddelade
i juli 2013 att man avser att ta fram ett
lagförslag som tillåter mitokondriebyte
under strikta former …«
kan den s k flaskhalseffekten vid oogenesen medföra att vissa
äggceller får märkbart högre proportioner av muterat mtDNA
än de somatiska cellerna, vilket även observerades i studien av
fetal makakvävnad [2]. Det betyder att det, även om man genom MST eller PNT skulle lyckas med att förhindra sjukdomsuppkomst hos ett barn, fortfarande kan finnas risk för
att sjukdom uppstår hos kommande generationer om barnet
är en flicka.
I en studie där man undersökte ärftlighetsmönster för en
mtDNA-sjukdom med en klinisk tröskel på ca 60 procent (stor
risk för sjukdom vid >60 procent muterat mtDNA) uppskattades risken för sjukdom i nästkommande generationer dock
vara mycket låg vid överföring av <3 procent oönskat DNA [12].
Om risken för sjukdomsuppkomst i påföljande generationer
vill undvikas helt, skulle man genom könsselektion kunna
välja ut befruktade ägg med Y-kromosom för återföring till
livmodern. En sådan könsselektion kan anses som etiskt kontroversiell, men bör sättas i relation till att det är tillåtet att
använda könsselektion för att undvika allvarliga könsbundna
sjukdomar.
Effekter av att introducera främmande mtDNA i cellen
I en forskningsstudie observerades fysiologiska nedsättningar
hos möss som med hjälp av PNT hade producerats för att innehålla två olika sorters mtDNA [13]. I det aktuella experimentet
användes mtDNA i proportioner om ca 50–50 procent från två
mustyper som genetiskt sett var mycket olika varandra, men
båda typerna av mtDNA var normala (ej sjukdomsalstrande)
var och en för sig. Resultaten tolkades i studien som att det kan
vara olyckligt att skapa heteroplasmi av två sorters mtDNA
som skiljer sig mycket åt. Dock visar forskning att MST och
PNT kan generera mycket lägre nivåer av heteroplasmi än 50
procent om tekniken optimeras. Om man vill undvika att skapa heteroplasmi av två sorters mtDNA med stor genetisk skillnad vid eventuell användning av tekniken på människor, skulle man kunna välja att använda donerat mtDNA som liknar
den sjukdomsdrabbade individens.
Farhågor har också uttryckts om att interaktionen mellan
kärn-DNA och mtDNA skulle kunna påverkas negativt av att
introducera »främmande« mtDNA i cellen. När makak-ungarna genererades användes dock två sorters mtDNA med hög genetisk diversitet (den genetiska skillnaden uppges vara större
än de skillnader som kan finnas i mtDNA mellan olika
människor), och inga problem har observerats hos ungarna
(som dock inte var fler än fyra) upp till 3 års ålder [10]. I denna
diskussion brukar det även påpekas att vid en vanlig befruktning är hälften av kärn-DNA:t – det som kommer från fadern –
i princip främmande för mtDNA:t, vilket inte orsakar några
(kända) problem.
Övriga risker
Kromosomskador skulle teoretiskt sett kunna induceras av
de reagenser som används vid MST och PNT, eller av någon
annan komponent i proceduren. Även om ingen förhöjd risk
för kromosomskador observerades hos makak-ungarna [9] eller i de humana stamcellslinjer som tillkommit efter MST [11],
är forskningsunderlaget mycket begränsat.
En annan farhåga som har uttryckts är om mikromanipuleringen av cellerna vid PNT och MST skulle kunna inducera
epigenetiska förändringar, eftersom ingreppet sker i ett känsligt skede under äggets epigenetiska omprogrammering. Kon-
ventionell IVF-behandling har associerats med viss ökad risk
för sällsynta epigenetiska sjukdomar, även om den totala risken för sjukdomarna fortfarande är mycket låg [14, 15]. I de
ovan nämnda studierna av MST och PNT har man inte specifikt letat efter epigenetiska förändringar, men de makaker
som har tillkommit med metoden har bedömts vara friska,
och de stamcellslinjer som genererats har haft ett till synes
normalt genuttryck [10, 11]. För att kunna upptäcka eventuella
epigenetiska förändringar till följd av MST och PNT skulle det
behövas långtidsuppföljningar av ett stort antal individer som
tillkommit med tekniken.
Utvecklingen i Storbritannien
I dag är tekniker för mitokondriebyte förbjudna att använda i
Sverige enligt lagen om genetisk integritet (2006:351), eftersom metoden medför genetiska förändringar som kan gå i arv.
För att tekniken skulle kunna användas inom forskning eller
behandling skulle alltså en lagändring krävas.
I Storbritannien har Human Reproduction and Fertilisation Authority (HFEA) på uppdrag av den brittiska regeringen
utvärderat aktuell forskning om MST och PNT med fokus på
eventuella medicinska risker [16, 17]. I rekommendationen till
regeringen konstaterade man bl a att forskningsresultaten
hittills inte tyder på att MST eller PNT skulle vara osäkra metoder. Man specificerade dock ett antal ytterligare forskningsprojekt som rekommenderas att utföra innan metoden
prövas kliniskt på människor.
HFEA fick även i uppdrag att genomföra ett omfattande offentligt samråd (public consultation) om frågan, och från detta drog man slutsatsen att det fanns ett gott stöd för tekniken
hos allmänheten [18].
Det brittiska etikrådet Nuffield Council on Bioethics har
också analyserat frågan ingående och kommit fram till att
tekniken är godtagbar om den kan bedömas som effektiv och
tillräckligt säker [19].
Storbritanniens regering meddelade i juli 2013 att man avser att ta fram ett lagförslag som tillåter mitokondriebyte under strikta former [20]. Förslaget förväntas behandlas i parlamentet under 2014. Det finns alltså anledning att anta att kliniska försök med mitokondriebyte kan komma att påbörjas i
Storbritannien inom en relativt nära framtid. Utvecklingen i
Storbritannien har fått stor internationell uppmärksamhet
och väckt debatt både angående den medicinska bedömningen [21] och de mer principiella frågorna kring tekniken [22].
Även i USA är tekniken mitokondriebyte under diskussion,
och frågan behandlades vid ett möte hos läkemedelsmyndigheten Food and Drug Administration (FDA) tidigare i år [23].
Etiska aspekter på mitokondriebyte
Mitokondriebyte aktualiserar den etiska konflikten mellan
intresset att undvika sjukdom och lidande hos ett blivande
barn och risken för att utsätta barnet för okända negativa effekter som tekniken eventuellt kan medföra. Att de genetiska
förändringar som introduceras vid mitokondriebyte kan gå i
arv innebär att sjukdom skulle kunna undvikas även hos kommande generationer, men det betyder också att eventuella risker som är förknippade med metoden kan föras vidare.
Liksom i många andra situationer innebär det vissa risker
att gå från experimentell forskning på celler och djur till kliniska försök på människor. Att avgöra när det är dags att ta
steget blir i dessa fall en bedömningsfråga utifrån tillgängligt
»… kom rådet fram till att mitokondriebyte inte var etiskt godtagbart mot bakgrund av den kunskapsosäkerhet som i
dag råder om de medicinska riskerna.«
3
■■ klinik & vetenskap översikt
forskningsunderlag och utifrån övriga risker och möjligheter
som är förknippade med att använda respektive avstå från
metoden.
Den sammanvägda riskbild som finns vid mitokondriebyte
– ofullständigt byte av mitokondrierna, kromosomavvikelser,
eventuella störningar i interaktionen mellan kärn-DNA och
mtDNA, epigenetiska störningar och okända risker – ska vägas mot de mer kända risker som en mitokondriell sjukdom
innebär, dvs svårt lidande och tidig död i de allvarligaste fallen. En kärnfråga i detta sammanhang är vilka förväntade biverkningsrisker som skulle kunna vara förenliga med en ansvarsfull klinisk användning av tekniken. Kunskapsunderlaget är ännu alltför bristfälligt för att kunna göra en sådan avvägning.
Ett mer principiellt etiskt problem är om det över huvud taget är acceptabelt att genetiskt modifiera befruktade eller
obefruktade ägg i syfte att undvika sjukdom. Det kan argumenteras att en gräns mot genetisk modifiering av människor
passeras om mitokondriebyte tillåts, vilket av olika skäl kan
anses oacceptabelt. Argumentet kan bottna i en rädsla för att
varje form av genmodifiering på sikt skulle kunna leda till en
glidning mot ökad acceptans avseende modifiering och förädling av människan, ofta kallad »det sluttande planet«. Det
sluttande planet-argumentet skulle även kunna beskrivas
som en typ av riskvärdering med avseende på risken att en
metod öppnar upp för andra metoder och tillämpningar.
När det gäller mitokondriebyte är metoden dock tydligt avgränsad till att beröra enbart mitokondriellt DNA, och metoden skulle inte kunna användas för att t ex modifiera gener i
cellkärnan. Denna distinkta tekniska avgränsning skulle
kunna innebära att en skiljelinje mot en vidare användning av
genmodifiering med större sannolikhet kan upprätthållas.
En annan aspekt som har diskuterats mycket internationellt är huruvida de barn som tillkommer genom mitokondriebyte skulle få »tre genetiska föräldrar« och vilka etiska
problem det skulle kunna innebära [24]. Den genetiska komponent som finns i mitokondrien är dock mycket liten i förhållande till cellens totala DNA – 37 gener jämfört med ca 20 000
transkriberade gener i cellkärnan [25]. Såvitt man vet påverkar inte mtDNA andra funktioner än de som hör till mitokondrien.
Smer avråder – osäkerhet om de medicinska riskerna
När Statens medicinsk-etiska råd (Smer) analyserade frågan
[26] kom rådet fram till att mitokondriebyte inte var etiskt
godtagbart mot bakgrund av den kunskapsosäkerhet som i
dag råder om de medicinska riskerna. I bedömningen vägde
rådet in att risken för allvarlig sjukdom visserligen kan vara
stor för de barn som föds med muterat mtDNA, men också att
det finns alternativa möjligheter för drabbade föräldrar att
med hjälp av äggdonation eller adoption få barn utan mitokondriella sjukdomar. Rådet ansåg vidare att de barn som
eventuellt tillkommer genom mitokondriebyte bör anses ha
två genetiska föräldrar och inte tre.
Rådet var dock inte enigt angående den principiella frågan.
Här ansåg en majoritet av rådets ledamöter att tekniken
skulle kunna vara godtagbar under förutsättning att metoden utvecklas så att riskerna bedöms som små. Huvudargumenten var att mycket svåra sjukdomar skulle kunna undvikas – sannolikt också i kommande generationer – och att byte
av mtDNA mycket tydligt kan avgränsas mot ingrepp i kärnDNA. En minoritet av ledamöterna tog principiellt avstånd
från tekniken. De ansåg att mitokondriebyte på sikt skulle
kunna innebära ett hot mot människovärdet och att sluttande planet-argumentet är högst relevant.
I rapporten efterlyser Smer en samhällelig diskussion om
genterapi för att undvika allvarliga sjukdomar, ett ämne som
inte har debatterats nämnvärt de senaste åren. Att debatten
4
är så ljum skulle möjligen kunna avspegla en allmänt mindre
ifrågasättande inställning till medicinska frontlinjeterapier
såsom somatisk genterapi, som också kan anses beröra etiska
värden.
Om nu de alltför stora kunskapsluckorna varit avgörande
för Smer:s ställningstagande, hur ska kunskapsluckorna då
täppas igen? Den brittiska rapporten om mitokondriebyte [17]
lyfter fram framför allt behovet av forskning på befruktade
och obefruktade humana ägg och stamceller från humana ägg
samt experiment i primatmodeller. Att Smer avråder från mitokondriebyte i svensk klinisk praxis i dag innebär inte på något sätt ett ställningstagande mot dessa typer av forskning.
n Potentiella bindningar eller jävsförhållanden: Inga uppgivna.
■■ summary
Mitochondrial inherited disorders may cause severe disease, suffer­
ing and premature death. Today, there are no effective treatments
available for the conditions. Novel techniques involving replacement
of mutated mitochondria with mitochondria from healthy donors in
association with IVF may provide a possibility to prevent children
from inheriting the disorders. Recent research results from studies
in primates and human cells have been reasonably promising.
However, no baby has yet been born through the technique, and
possible short and long term risks in humans are difficult to predict.
Furthermore, the technique causes genetic alterations that are inher­
ited, and thus raises fundamental ethical questions. The Swedish
National Council on Medical Ethics has advised that mitochondrial
replacement should not be used in humans in Sweden until more
scientific knowledge is available.
■■ klinik & vetenskap översikt
REF E RE NSE R
1. Jenuth JP, Peterson AC, Fu K, et al.
Random genetic drift in the female
germline explains the rapid segregation of mammalian mitochondrial DNA. Nat Genet. 1996;14(2):
146-51.
2. Lee HS, Ma H, Juanes RC, Tachibana M, et al. Rapid mitochondrial
DNA segregation in primate
preimplantation embryos precedes
somatic and germline bottleneck.
Cell Rep. 2012;1(5):506-15.
3. Schaefer AM, McFarland R, Blakely EL, et al. Prevalence of mitochondrial DNA disease in adults.
Ann Neurol. 2008;63(1):35-9.
4. Bredenoord AL, Dondorp W, Pennings G, et al. PGD to reduce reproductive risk: the case of mitochondrial DNA disorders. Hum
Reprod. 2008;23(11):2392-401.
5. Hellebrekers DM, Wolfe R, Hendrickx AT, et al. PGD and heteroplasmic mitochondrial DNA point
mutations: a systematic review
estimating the chance of healthy
offspring. Hum Reprod Update.
2012;18(4):341-9.
6. BBC News. Foetus with three parents created. 10 okt 2003 [citerat 4
dec 2013]. http://news.bbc.co.
uk/2/hi/health/3189718.stm
7. Sato A, Kono T, Nakada K, et al.
Gene therapy for progeny of mito-mice carrying pathogenic mtDNA by nuclear transplantation.
Proc Natl Acad Sci U S A. 2005;102
(46):16765-70.
8. Craven L, Tuppen HA, Greggains
GD, et al. Pronuclear transfer in
human embryos to prevent transmission of mitochondrial DNA
disease. Nature. 2010;465(7294):
82-5.
9. Tachibana M, Sparman M, Sritanaudomchai H, et al. Mitochondrial gene replacement in primate
offspring and embryonic stem
cells. Nature. 2009;461(7262):36772.
10. Tachibana M, Amato P, Sparman
M, et al. Towards germline gene
therapy of inherited mitochondrial
diseases. Nature. 2013;493(7434):
627-31.
11. Paull D, Emmanuele V, Weiss KA,
et al. Nuclear genome transfer in
human oocytes eliminates mitochondrial DNA variants. Nature.
2013;493(7434):632-7.
12. Samuels DC, Wonnapinij P, Chinnery PF. Preventing the transmission of pathogenic mitochondrial
DNA mutations: can we achieve
long-term benefits from germ-line
gene transfer? Hum Reprod. 2013;
28(3):554-9.
13. Sharpley MS, Marciniak C, EckelMahan K, et al. Heteroplasmy of
mouse mtDNA is genetically unstable and results in altered behavior and cognition. Cell. 2012;151
(2):333-43.
14. Källén B, Finnström O, Lindam A,
et al. Congenital malformations in
infants born after in vitro fertilization in Sweden. Birth Defects Res A
Clin Mol Teratol. 2010;88(3):13743.
15. van Montfoort AP, Hanssen LL, de
Sutter P, et al. Assisted reproduction treatment and epigenetic inheritance. Hum Reprod Update.
2012;18(2):171-97.
16. Haites N, Lovell-Badge R. Scientific review of the safety and efficacy
of methods to avoid mitochondrial
disease through assisted conception. London: Human Fertilisation
and Embryology Authority; 2011.
17. Haites N. Scientific review of the
safety and efficacy of methods to
avoid mitochondrial disease
through assisted conception: update. London: Human Fertilisation
and Embryology Authority; 2013.
18. Human Fertilisation and Embryology Authority. Mitochondria replacement consultation: Advice to
Government. Mars 2013 [citerat 4
dec 2013]. http://www.hfea.gov.uk/
docs/Mitochondria_replacement_
consultation_-_advice_for_Government.pdf
19. Novel techniques for the prevention of mitochondrial DNA disorders: an ethical review. London:
Nuffield Council on Bioethics;
2012.
20.UK Department of Health/Human
Fertilisation and Embryology Authority. Innovative genetic treatment to prevent mitochondrial
disease [pressmeddelande]. 28 jun
2013 [citerat 4 dec 2013]. https://
www.gov.uk/government/news/
innovative-genetic-treatment-to-prevent-mitochondrial-disease
21. Reinhardt K, Dowling DK, Morrow
EH. Mitochondrial replacement,
evolution, and the clinic. Science.
2013;341 (6152):1345-6.
22.Darnovsky M. A slippery slope to
human germline modification.
Nature. 2013;499(7457):127.
23.US Food and Drug Administration.
Advisory Committee Calendar.
http://www.fda.gov/AdvisoryCommittees/Calendar/
ucm380042.htm
24.Baylis F. The ethics of creating
children with three genetic parents. Reprod Biomed Online.
2013;26(6):531-4.
25. McHale CM, Zhang L, Thomas R,
et al. Analysis of the transcriptome
in molecular epidemiology studies.
Environ Mol Mutagen. 2013;54(7):
500-17.
26.Smer. Mitokondriebyte för att undvika allvarlig ärftlig sjukdom –
etiska aspekter. Stockholm: Statens medicinsk-etiska råd; 2013.
Rapport 2013:2.
5













